目次
化学反応
化学反応は暗記ではない!
A + B → C + D を覚えろ!ではない。
AとBという物質が与えられたとき、どのような反応が起こるのかを推測できる力が大切である。
その材料(考え方)について学んでいく。
宇宙に存在する元素のうち,質量 % で 2 番目に多い元素は何か。元素記号で答えよ。
温度とは?
粒子のスピードが遅くなってくると・・・
物質の構成粒子
電子の質量は,陽子の質量の約1/1840である。
陽子·中性子·電子の質量と電荷
| 粒子 | 質量 | 質量比 | 電荷 |
|---|---|---|---|
| 陽子 | \( 1.673 \times 10^{-24} \) | 約 1840 | \( +1.6 \times 10^{-19} (\mathrm{C}) \) |
| 中性子 | \( 1.675 \times 10^{-24} \) | 約 1840 | \( \pm 0 \) |
| 電子 | \( 9.109 \times 10^{-28} \) | 1 | \( -1.6 \times 10^{-19} (\mathrm{C}) \) |
化学反応の考え方
引き合う力
- 万有引力(質量の存在するものすべてに働く)
- 静電気力(+とーの力、引力、斥力がある)
拡散(エントロピー)
水和
水に溶けるということは、どういうことか?
錯イオンの中心金属と配位子
錯イオンの形
- 2配位:\( \mathrm{Ag^+} \)(直線型)
- 4配位:\( \mathrm{Zn^{2+}} \)(正四面体型),\( \mathrm{Cu^{2+}} \)(正方形型)
- 6配位:\( \mathrm{Fe^{2+}、Fe^{3+}、Al^{3+}} \)(正八面体型)
金属と配位子の相性
- \( \mathrm{Ag^+:NH_3,S_2O_3^{2−}} \)
- \( \mathrm{Cu^{2+}:NH_3} \)
- \( \mathrm{Zn^{2+}:NH_3,OH^−} \)
- \( \mathrm{Al^{3+}:OH^−} \)
- \( \mathrm{Fe^{2+}:CN^−} \)
- \( \mathrm{Fe^{3+}:CN^−} \)
酸・塩基反応
酸
塩基
| 塩酸 | \( \mathrm{HCl} \) |
| 臭化水素 | \( \mathrm{HBr} \) |
| ヨウ化水素 | \( \mathrm{HI} \) |
| 硝酸 | \( \mathrm{HNO_3} \) |
| 硫酸 | \( \mathrm{H_2SO_4} \) |
| 酢酸 | \( \mathrm{CH_3COOH} \) |
| 炭酸 | \( \mathrm{H_2CO_3} \) |
| リン酸 | \( \mathrm{H_3PO_4} \) |
| 硫化水素 | \( \mathrm{H_2S} \) |
| 水酸化ナトリウム | \( \mathrm{NaOH} \) |
| 水酸化カリウム | \( \mathrm{KOH} \) |
| 水酸化カルシウム | \( \mathrm{Ca(OH)_2} \) |
| 水酸化バリウム | \( \mathrm{Ba(OH)_2} \) |
| アンモニア | \( \mathrm{NH_3} \) |
| 水酸化鉄(Ⅱ) | \( \mathrm{Fe(OH)_2} \) |
| 水酸化鉄(Ⅲ) | \( \mathrm{Fe(OH)_3} \) |
| 水酸化アルミニウム | \( \mathrm{Al(OH)_3} \) |
| 水酸化マグネシウム | \( \mathrm{Mg(OH)_2} \) |
| 水酸化亜鉛 | \( \mathrm{Zn(OH)_2} \) |
| 水酸化銅(Ⅱ) | \( \mathrm{Cu(OH)_2} \) |
| 水酸化鉛 | \( \mathrm{Pb(OH)_2} \) |
問題
- H+ と OH-
- 弱酸、弱塩基
- 酸性酸化物、塩基性酸化物
- 炭酸の平衡定数 \( K_{a_1} = 10^{-6.3},K_{a_2} = 10^{-10.3} \)
- リン酸の平衡定数 \( K_{a_1} = 10^{-2.2},K_{a_2} = 10^{-7.3},K_{a_3} = 10^{-12.3} \)
不揮発性の酸の遊離
濃硫酸:濃\( H_2SO_4 \)
- \( NaCl + 濃H_2SO_4 \longrightarrow NaHSO_4 + HCl \)
- \( CaF_2 + 濃H_2SO_4 \longrightarrow CaSO_4 + 2HF \)
酸化還元反応
- 酸化剤と還元剤
イオン化傾向
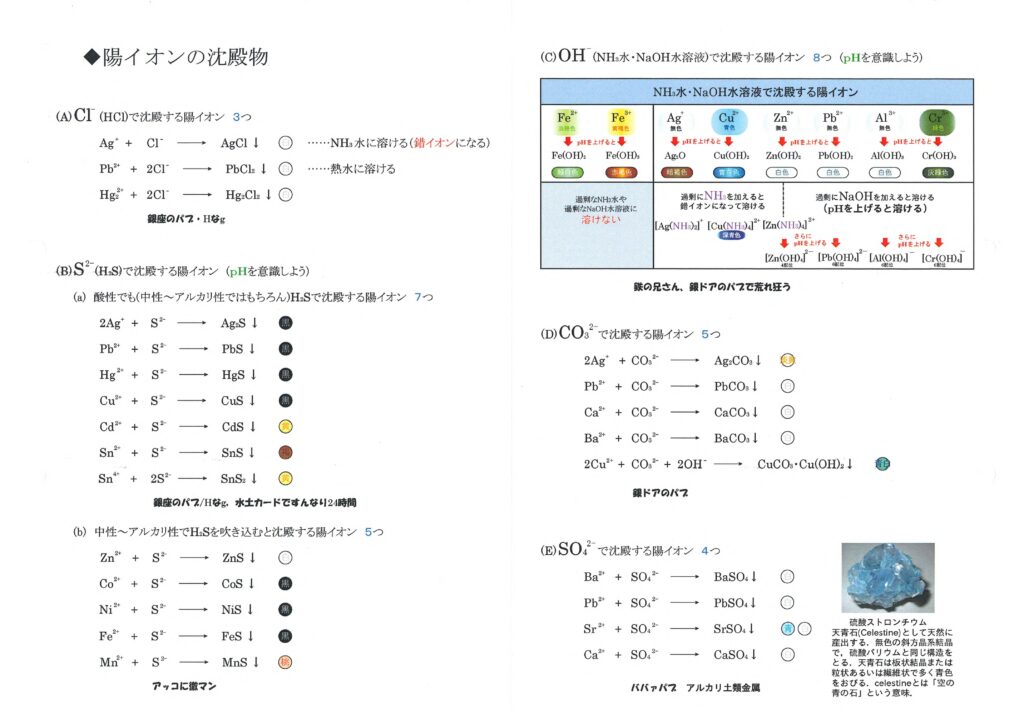
沈殿生成反応
\( \mathrm{Cl^-} \) で沈殿する陽イオン
- \( \mathrm{\mathbf{Ag^+} + Cl^- \longrightarrow AgCl} \)
- \( \mathrm{\mathbf{Pb^{2+}} + 2Cl^- \longrightarrow PbCl_2} \)
- \( \mathrm{\mathbf{Hg_2^{2+}} + 2Cl^- \longrightarrow Hg_2Cl_2} \)
炭素・アルミニウムは酸素と仲がよい
酸化還元反応
\( \mathrm{2KI + Cl_2 \longrightarrow 2KCl + I_2} \)
\( \mathrm{CaCl(ClO)・H_2O + 2HCl \longrightarrow CaCl_2 + Cl_2 + 2H_2O} \)
\( \mathrm{2KI + Cl_2 \longrightarrow 2KCl + I_2} \)
\( \mathrm{2KI + Cl_2 \longrightarrow 2KCl + I_2} \)
\( \mathrm{2KI + Cl_2 \longrightarrow 2KCl + I_2} \)